Forschung
Der Darm übernimmt eine wichtige Steuerungsfunktion in der Kommunikation zwischen Umweltfaktoren, Stoffwechsel und Immunsystem. Die Häufigkeit chronisch entzündlicher und metabolischer Erkrankungen nimmt in industrialisierten Ländern dramatisch zu, und der Darm als Grenzflächenorgan spielt dabei eine wichtige Rolle.
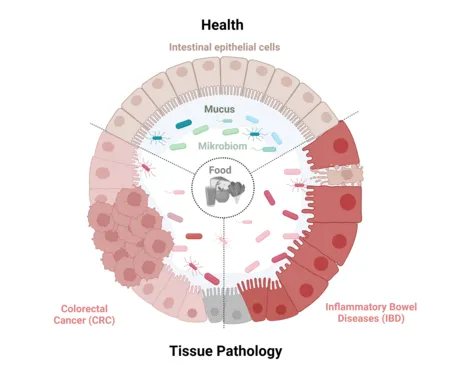
Die Wechselwirkung der Mikroben und deren Metabolite mit dem Darmepithel hat zahlreiche Auswirkungen auf Körperfunktionen und die Entstehung ernährungsmitbedingter Erkrankungen. Das intestinale Mikrobiom definiert sich als Gesamtheit aller Mikroorganismen (Mikrobiota), einschließlich Bakterien, Archaeen, Viren, Hefen und Protozoen, und deren physio-chemischen Eigenschaften im Darm. Das Metagenom beschreibt die Gesamtheit aller Genome und erlaubt einen Einblick in das funktionelle Repertoire der Mikrobiota. Das intestinale Mikrobiom ist sehr unterschiedlich zwischen Individuen, und wird ein Leben lang von vielen Umwelteinflüssen wie Ernährung, Lebensumfeld, Gesundheitsstatus und Arzneimitteleinnahme beeinflusst. Es zeichnet sich dennoch durch ein hohes Maß an Stabilität (Resilienz) im gesunden Organismus aus. Kompositionelle und funktionelle Änderungen im Mikrobiom sind ursächlich beteiligt sind an der Pathogenese chronisch entzündlicher Darmerkrankungen (ICED), wie Morbus Crohn und Colitis ulcerosa, und Darmkrebs (CRC). Die Ernährung ist ein Umweltfaktor, der die Zusammensetzung und Aktivität der Mikroben im Darm beeinflusst, und darüber einen Einfluss auf die Erkrankungsgenese ausübt. Untersuchungen zur Wechselwirkung zwischen Ernährung und Mikrobiom sind einer der wesentlichen Fokusthemen am Lehrstuhl für Ernährung und Immunologie.
Das intestinale Mikrobiom tauscht sich über die Grenzfläche Darm mit dem Wirtsorganismus aus. Der Darm agiert als selektive Barriere und ermöglicht es, dass Mikroorganismen im Darmlumen verbleiben, lebenswichtige Mikro- und Makronährstoffe hingegen aufgenommen werden können. Die Aufrechterhaltung der immunologischen und physischen Darmbarriere ist daher von immenser Bedeutung. Eine Schädigung oder Fehlfunktion der intestinalen Barriere- und Immunfunktion kann zu einer mikrobiellen Translokation über das Darmepithel und damit zu einer überschießenden Entzündungsreaktion oder Tumorentstehung führen. Die Wechselwirkungen kommensaler Mikroben mit dem Epithel greifen entscheidend in die Steuerung der Epithelzellhomöostase ein, und Untersuchungen zu pathologischen Veränderungen im Darmepithel stehen als weiteres Fokusthema im Zentrum der wissenschaftlichen Arbeiten am Lehrstuhl.
Morbus Crohn und Colitis ulcerosa sind multifaktorielle und komplexe Erkrankungen, die durch eine Kombination aus genetischer Prädisposition und Umweltfaktoren angetrieben werden. Colitis ulcerosa betrifft ausschließlich den Dickdarm, dessen Schleimhaut kontinuierlich vom Enddarm in Richtung proximales Colon entzündet ist. Morbus Crohn kann den gesamten Gastrointestinaltrakt und alle Schichten des Darms betreffen und tritt diskontinuierlich und segmental auf. Die Symptome treten meist in Schüben auf, gefolgt von Remissionsphasen, und reichen von der klinisch symptomfreien Remission, die aber trotzdem mit anhaltender subklinischer Entzündung einhergehen kann, über klinische Beschwerden mit abdominalen Schmerzen und Durchfall bis hin zu blutigem Stuhl, Darmverschlüssen und Fistelbildung bis hin zur Entwicklung von Dickdarmkrebs. Bei CED Patienten kommt es zu einer unkontrollierten und übermäßigen Immunreaktion gegenüber der eigenen intestinalen Mikrobiota, einhergehend mit einer Reduktion der Darmbarriere und einem Funktionsverlust des innaten Immunsystems. Toleranzmechanismen des adaptiven Immunsystems sind ebenfalls gestört. Gründe sind u.a. Defekte in der Regulation von zellulärem Stress und der Mitochondrienfunktion, was zu einer Fehlfunktion in der Differenzierung und Regeneration der epithelialen Barriere führen kann. Chronische Entzündung und unvollständig abgeheilte Läsionen im Darm führen zu einem schädigendem Gewebeumbau bis hin zur Krebsentstehung. Das Mikrobiom spielt eine entscheidende Rolle in der Pathogenese von Morbus Crohn und Colitis ulcerosa als auch Krebs. Hier entwickelt das Team um Prof. Haller neue Tiermodelle und untersucht den Einfluss von kommensalen Mikroben und Nahrungsfaktoren.
Der Lehrstuhl ist beteiligt an prospektiven Kohorten und führt kontrollierte Interventionsstudien in Neugeborenen, gesunde Probanden und Patienten durch. Ziel dieser Humanstudien ist es, den Einfluss von Ernährung bzw. spezifischer Nahrungsbestandteile und weiteren Umweltfaktoren auf die Zusammensetzung und Funktion des Mikrobioms im Darm besser zu verstehen.
Laufende Projekte:
Zirkadiane Regulation des Darmmikrobioms über die gesamte Lebensspanne
Einfluss von Pro- und Präbiotika auf das Mikrobiom im Säuglingsdarm
Wirkung enteraler Ernährungstherapie bei Kindern mit Morbus Crohn
Einfluss prozessierter Lebensmittel auf das Mikrobiom im Darm
Laufende Interventionstudien:
Einfluss der Mikroalge Chlorella sorokiniana auf Mikrobiom-Host-Interaktionen beim Menschen (ZIEL PhD Programm und TUMCreate Proteins4Singapore)
Effekt von Ballaststoffen und Polyphenolen aus Süßlupinen- und Sonnenblumen-mehl auf das Mikrobiom (FEI)
Fecal microbiota transfer for maintenance of remission after induction treatment with exclusive enteral nutrition in Crohn’s disease (EN-RICH, The Leona M. and Harry B. Helmsley Charitable Trust)
Ausgewählte Publikationen:
Heppner N, Reitmeier S, Heddes M, Vig Merino M, Schwartz L, Dietrich A, List M, Gigl M, Meng C, R van der Veen D, Schirmer M, Kleigrewe K, Omer H, Kiessling S, Haller D*. Diurnal rhythmicity of infant fecal microbiota and metabolite profiles: a randomized controlled interventional trial with infant formula. Cell Host & Microbe. 2024 April 10.
Reitmeier S, Kiessling S, Clavel T, List M, Almeida EL, Ghosh TS, Neuhaus K, Grallert H, Linseisen J, Skurk T, Brandl B, Breuninger TA, Troll M, Rathmann W, Linkohr B, Hauner H, Laudes M, Franke A, Le Roy CI, Bell JT, Spector T, Baumbach J, O'Toole PW, Peters A, Haller D*. Arrhythmic Gut Microbiome Signatures Predict Risk of Type 2 Diabetes. Cell Host & Microbe. 2020 Jun 29:1931-3128(20)30343-7.
Lee T, Clavel T, Smirnov K, Schmidt A, Lagkouvardos I, Walker A, Lucio M, Michalke B, Schmitt-Kopplin P, Fedorak R, Haller D*. Oral versus intravenous iron replacement therapy distinctly alters the gut microbiota and metabolome in patients with IBD. Gut. 2017;66:863-871.
Bazanella M, Maier TV, Clavel T, Lagkouvardos I, Lucio M, Maldonado-Gòmez MX, Autran C, Walter J, Bode L, Schmitt-Kopplin P, Haller D*. Randomized controlled trial on the impact of early-life intervention with bifidobacteria on the healthy infant fecal microbiota and metabolome. Am J Clin Nutr. 2017 Nov;106(5):1274-1286.
Rath E, Berger E, Messlik A, Nunes T, Liu B, Kim SC, Hoogenraad N, Sans M, Sartor RB, Haller D*. Induction of dsRNA-activated protein kinase links mitochondrial unfolded protein response to the pathogenesis of intestinal inflammation. Gut 2012;61(9):1269-78
Der Lehrstuhl entwickelt neue Tiermodelle für chronische Darmerkrankungen. Hier stehen Fragen zur Rolle der Mikroben-Wirt-Interaktion für die Entstehung chronischer Entzündungskrankheiten, wie Morbus Crohn und Colitis ulcerosa, und Darmkrebs im Mittelpunkt der Untersuchungen. Keimfreie Tiermodelle für Entzündung und Krebs sind Alleinstellungsmerkmal der Lehrstuhlexpertise. Die selektive Kolonisierung dieser Tiermodelle mit dem Stuhlmikrobiom von Patienten und synthetischen Mikrobenkonsortien erlauben die funktionelle und mechanistische Charakterisierung der Mikroben-Wirt-Interaktion.
Laufende Projekte:
Bedeutung von Mitochondrien im Darmepithel auf Wundheilung und Entzündung
Activating Transcription Factor (ATF)-6 in der Entstehung von Dickdarmkrebs
Einfluss prozessierter Lebensmittel auf Mikrobiom, Entzündung und Krebs
Ernährungstherapie durch exclusive enteral nutrition (EEN)
Tiermodelle:
Organspezifische/keimfreie Hsp60-/- (Darm, Leber, Fett) Entzündungsmodelle
Organspezifische/keimfreie nAtf6 transgene (Darm, Leber) Krebsmodelle
Morbus Crohn Entzündungsmodelle in Maus und Schwein (TNFDARE)
Ausgewählte Publikationen:
Urbauer E, Aguanno D, Mindermann N, Omer H, Metwaly A, Krammel T, Faro T, Remke M, Reitmeier S, Bärthel S, Kersting J, Huang Z, Xian F, Schmidt M, Saur D, Huber S, Stecher B, List M, Gómez-Varela D, Steiger K, Allez M, Rath E, Haller D*. Mitochondrial perturbation in the intestine causes microbiota-dependent injury and gene signatures discriminative of inflammatory disease. Cell Host & Microbe 2024 Jul 10 doi: 10.1016/j.chom.2024.06.013
Coleman OI, Sorbie A, Bierwirth S, Kövilein J, von Stern M, Köhler N, Wirbel J, Schmidt C, Kacprowski T, Dunkel A, Pauling JK, Plagge J, Mediel-Cuadra D, Wagner S, Peng T, Metzler T, Schafmayer C, Hinz S, Röder C, Röcken C, Stecher B, Rosenstiel P, Steiger K, Jesinghaus M, Liebisch G, Ecker J, Zeller G, Janssen KP, Haller D*. ATF6 activation alters colonic lipid metabolism causing tumor-associated microbial adaptation. 10.1101/2023.11.03.565267 bioRxiv
Winogrodzki T, Metwaly A, Grodziecki A, Liang W, Klinger B, Flisikowska T, Fischer K, Flisikowski K, Steiger K, Haller D*, Schnieke A*. TFF DARE pigs: A translational Crohn’s diease model. J Crohns Colitis. 2023 Jul 5;17(7):1128-1138.
Coleman OI, Lobner EM, Bierwirth S, Sorbie A, Waldschmitt N, Rath E, Berger E, Lagkouvardos I, Clavel T, McCoy KD, Weber A, Heikenwalder M, Janssen KP, Haller D*. Activated ATF6 Induces Intestinal Dysbiosis and Innate Immune Response to Promote Colorectal Tumorigenesis. Gastroenterology. 2018 Nov;155(5):1539-1552.
Yuan D, Huang S, Berger E, (…), Haller D*, Heikenwalder M*. Kupffer Cell-Derived Tnf Triggers Cholangiocellular Tumorigenesis through JNK due to Chronic Mitochondrial Dysfunction and ROS. Cancer Cell. 2017;31:771-789.
Schaubeck M, Clavel T, Calasan J, Lagkouvardos I, Haange SB, Jehmlich N, Basic M, Dupont A, Hornef M, von Bergen M, Bleich A, Haller D*. Dysbiotic gut microbiota causes transmissible Crohn's disease-like ileitis independent of failure in antimicrobial defence. Gut. 2016;65:225-37.
Waldschmitt N, Berger E, Rath E, Sartor RB, Weigmann B, Heikenwalder M, Gerhard M, Janssen KP, Haller D*. C/EBP homologous protein inhibits tissue repair in response to gut injury and is inversely regulated with chronic inflammation. Mucosal Immunol. 2014 Nov;7(6):1452-66.
Das Darmepithel formt eine essentielle Barriere und agiert als interaktive Grenzfläche zwischen Mikrobiom und Ernährung. Zellorganellen wie das endoplasmatische Retikulum (ER) und Mitochondrien spielen eine wichtige Rolle in der Fähigkeit des Darmepithels zur Regeneration. Eine zentrale Arbeitshypothese des Lehrstuhls ist, dass Signalgeber (z.B. Activating Transcription Factor 6) der ER-assoziierten unfolded protein response (ER-UPR) und Stressmechanismen in Mitochondrien die Fähigkeit von Darmepithelzellen zur Differenzierung und Regenration kontrollieren. Mit Hilfe neuer Mausmodelle und Zellmodellen werden neue Ansätze zur Prävention und Therapie von Entzündungerkrankungen und Krebs im Darm entwickelt.
Laufende Projekte:
Repurposing von Medikamenten zur Verbesserung der Wundheilung im Darm
Wirkung von H2S (Desulfovibrio ssp.) auf die Tumorentstehung im Darm
Identifizierung protektiver Metabolite aus dem Darmmikrobiom
Wirkung von Fettsäuren auf die Tumorentstehung
Methoden- und Modellsysteme:
Darmorganoide aus Maus- und Schweinemodellen
Kontinuierliche Kultursysteme für das Stuhlmikrobiom (Chemostat)
16S und Metagenomsequenzierung von Stuhl- und Biopsieproben
Fluoreszenz-basierte Untersuchungen von Mikroben und Gewebe
Ausgewählte Publikationen:
Häcker D, Siebert K, Smith BJ, Köhler N, Heimes H, Metwaly A, Mahapatra A, Hölz H; De Zen F, Heetmeyer J, Socas K, Le Thi G, Meng C, Kleigrewe K, Pauling JK, Neuhaus K, List M, Pollard K, Schwerd T*, Haller D*. Exclusive Enteral Nutrition Initiates Protective Microbiome Changes to Induce Remission in Pediatric Crohn's Disease. 10.1101/2023.12.21.23300351 medRxiv
Metwaly A, Jovic J, Waldschmitt N, Khaloian S, Heimes H, Häcker D, Ahmed M, Hammoudi N, Le Bourhis L, Mayorgas A, Siebert K, Basic M, Schwerd T, Allez M, Panes J, Salas A, Bleich A, Zeissig S, Schnupf P, Cominelli F, Haller D*. Diet prevents the expanson of segmented filamentous bacteria and ileo-colonic inflammation in a model of Crohn’s disease. Microbiome 2023 Mar 31;11(1):66.
Khaloian S, Rath E, Hammoudi N, Gleisinger E, Blutke A, Giesbertz P, Berger E, Metwaly A, Waldschmitt N, Allez M, Haller D*. Mitochondrial impairment drives intestinal stem cell transition into dysfunctional Paneth cells predicting Crohn's disease recurrence. Gut. 2020 Nov;69(11):1939-1951.
Berger E, Rath E, Yuan D, Waldschmitt N, Khaloian S, Allgauer M, Staszewski O, Lobner EM, Schottl T, Giesbertz P, Coleman OI, Prinz M, Weber A, Gerhard M, Klingenspor M, Janssen KP, Heikenwalder M, Haller D*. Mitochondrial function controls intestinal epithelial stemness and proliferation. Nature Commun. 2016;7:13171.
von Schillde MA, Hormannsperger G, Weiher M, Alpert CA, Hahne H, Bauerl C, van Huynegem K, Steidler L, Hrncir T, Perez-Martinez G, Kuster B, Haller D*. Lactocepin secreted by Lactobacillus exerts anti-inflammatory effects by selectively degrading proinflammatory chemokines. Cell Host & Microbe. 2012;11:387-96.
Ocvirk S, Sava IG, Steck N, Roh JH, Tchaptchet S, Bao Y, Hansen JJ, Huebner J, Murray BE, Sartor RB, Haller D*. Surface-associated lipoproteins link Enterococcus faecalis virulence to colitogenic activity in IL-10-deficient mice independent of their expression levels. PLoS Pathog.2015 Jun 12;11(6):e1004911
Folgende Übersichtsartikel verschaffen einen Einblick in die Arbeitshypothesen am Lehrstuhl für Ernährung und Immunologie:
Metwaly A, Reitmeier S, Haller D*. Microbiome risk profiles as disease biomarkers for inflammatory and metabolic disorders. Nat Rev Gastroenterol Hepatol. 2022;19(6):383-397.
Rath E, Moschetta A, Haller D*. Mitochondrial function – gatekeeper of intestinal epithelial cell homeostasis. Nat Rev Gastroenterol Hepatol. 2018 Aug;15(8):497-516.
Renz H*, von Mutius E, Brandtzaeg P, Cookson WO, Autenrieth IB, Haller D*. Gene-environment interaction in chronic inflammatory disease. Nat Immunol. 2011 Apr;12(4):273-7.