Forschungsprojekte
Aktuelle Projekte
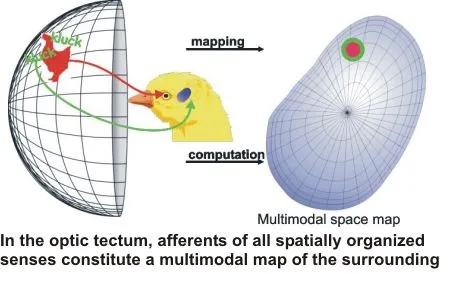
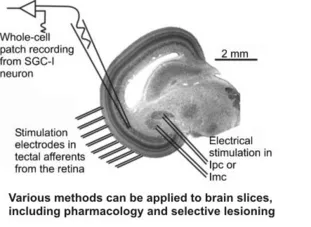
Die grundlegende informationsverarbeitende Einheit im Gehirn sind Nervenzellen. Ausgehend von der dendritischen Organisation versuchen wir, die Verarbeitung von afferenten Eingängen in einzelnen Zellen zu verstehen. Dabei nutzen wir vor allem lebende Gehirnschnitte, in denen wir mit whole-cell patch Ableitungen und gezielten Elektrostimulationen die Physiologie von Einzelzellen möglichst umfassend beschreiben. Zusammen mit Informationen über die afferenten Eingänge und die efferente Projektion der Zellen sowie deren Transmitter modellieren wir dann das Verhalten bei definierten Eingängen; diese Modelle werden dann im Schnitt erneut validiert, bis ein möglichst umfassendes Verständnis der Rolle einzelner Neurone erzielt ist. Als Modellsystem verwenden wir vor allem das visuelle Mittelhirn von Wirbeltieren, bevorzugt das optische Tectum von Vögeln. Diese Struktur hat verschiedene Vorteile: Die Afferenzen von diversen sensorischen Systemen bilden eine multimodale Karte des Raumes auf dem Tectum ab, damit ist eine Elektrostimulation in Mustern auch im isolierten Präparat möglich. Die gut definierte Schichtung des Tectums erlaubt es zudem, an den Zelltypen bestimmter Schichten gezielt zu arbeiten und damit umfassende Daten zu sammeln. Weiterhin ist die retino-tectale Projektion bei Vögeln ein gut untersuchtes Modell für Entwicklungsvorgänge, so dass eine Vielzahl von molekularen Daten für das optische Tectum vorhanden ist. Es ist daher möglich, einen sehr detaillierten „Schaltplan“ für das Tectum zu erstellen, der wiederum die Analyse einzelner Elemente erleichtert.
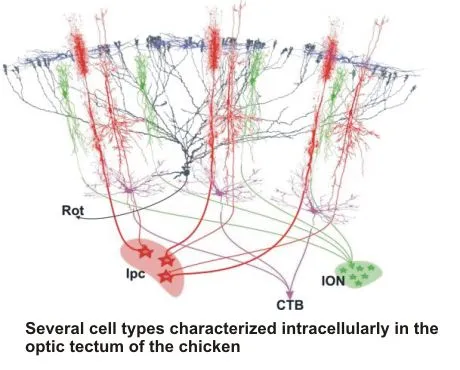
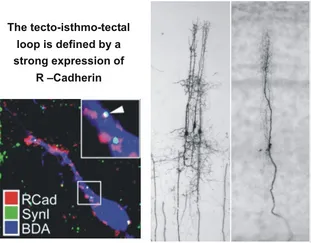
Die Analyse von einzelnen Zelltypen ist nur der Ausgangspunkt für die Untersuchung von kleinen neuronalen Verschaltungen und deren sukzessiver Einbindung in größere Netzwerke. Als Beispiel für ein solches System untersuchen wir zur Zeit intensiv die Rückkoppelungsschleife des optischen Tectum mit dem isthmischen System. Dieses System mit drei gut abgegrenzten Nuclei bildet ein beinahe exklusives Rückkoppelungssystem mit dem Tectum, dessen Anatomie bis auf Einzelzellebene bereits sehr gut bekannt ist. Da Teile dieses Netzwerks in einem Gehirnschnitt erhalten bleiben, bietet sich die Möglichkeit, Rückkoppelungsnetzwerke in vitro zu untersuchen und alle Vorteile dieser Präparation (selektive Stimulation, leichte patch-Ableitung, Manipulationsmöglichkeit, selektive mikrochirurgische und pharmakologische Entfernung einzelner Komponenten) zu nutzen. Die voraussichtliche Funktion dieses Systems ist die Etablierung einer winner-takes-all Verschaltung, die im optischen Tectum mehrdeutige Aktivierungsmuster auf eindeutige Muster reduzieren könnte.
Durch die Untersuchung molekularer Faktoren, die die Verschaltung des isthmischen Systems während der Embryonalentwicklung steuern (z.B. R-Cadherin), könnte eine Manipulation einzelner Komponenten der Rückkoppelungsschleife während der Entwicklung gelingen. Zukünftige Arbeiten sind darauf ausgerichtet, mit RNAi gezielte Ausschaltungen vorzunehmen und die resultierende Verschaltung elektrophysiologisch und funktionell zu charakterisieren.
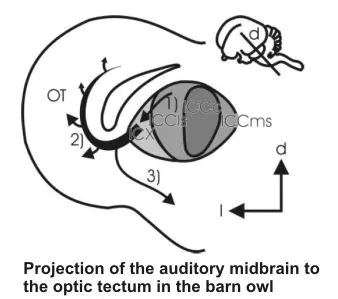
Die multimodale Karte im optischen Tectum wird in der Entwicklung dominiert durch den visuellen Eingang; nicht-visuelle Afferenzen (auditorisch, somatosensorisch, Seitenlinie, Infrarotsystem) passen sich an die von den retinalen Afferenzen vorgegebene master map an. Wie die Diskrepanz in experimentell und natürlich hervorgerufenen Kartenverschiebungen gemessen wird, und wie das System darauf reagiert, ist beispielhaft von der Arbeitsgruppe von Knudsen an der Schleiereule gezeigt worden. Wir haben die Entwicklung der Projektion des auditorischen Mittelhirns in das Tectum bei Schleiereulen untersucht und mit intrazellulären Methoden Zellen identifiziert, die aus dem Tectum heraus das Fehlersignal in der Kartenabstimmung an die Auditorik zurückmelden könnten. Weitere Untersuchungen zur exakten Verschaltung dieses Netzwerks sind zur Zeit bei Hühnern in Arbeit.

Neuronale Netzwerke müssen sich in der Embryonalentwicklung finden und korrekt verschalten. Für nestflüchtende Tiere, beispielsweise Hühner, ist dies um so dringlicher, als es keine längere Nestphase mit der Möglichkeit der Abstimmung des neuronalen Netzwerkes gibt. Die Determination der Zell-Zell-Interaktionen beruht auf einem komplexen Zusammenspiel genetischer Faktoren, molekularer Marker und elektrischer Erregungsmuster. Wir haben in den vergangenen Jahren die zelluläre Entwicklung verschiedener Zelltypen im optischen Tectum sowie in der auditorischen Bahn untersucht und dazu Zellkulturverfahren eingesetzt. Dabei haben wir Methoden zur magnetgestützten Sortierung spezifischer Zelltypen etabliert und die zelluläre Entwicklung in Abhängigkeit verschiedener Faktoren analysiert. Ein Nebenaspekt dieser Arbeiten liegt im Aufbau biohybrider Schaltkreise, also einer direkten Verkoppelung neuronaler Zellen mit technischen informationsverarbeitenden Strukturen; mit diesen Arbeiten soll die Bedeutung elektrischer Erregung auf Entwicklungsvorgänge herausgearbeitet werden.
Geplante Projekte:
Mit der Übernahme des Lehrstuhls für Zoologie an der TUM sind neue Möglichkeiten für weitere Arbeiten gegeben. Ein wichtiger Punkt werden Untersuchungen an verhaltenden Tieren sein. Nachdem wir glauben, für einige Zelltypen und Verschaltungen Funktionen charakterisiert zu haben, wollen wir diese Vorstellungen in intakten Tieren testen. Dazu werden Multielektroden-Ableitungen etabliert werden, idealerweise im frei beweglichen und sich verhaltenden Tier.
Die zeitliche Dynamik von Rückkoppelungsschleifen lässt sich nur begrenzt mit Einzelzellableitungen untersuchen. In einem bereits begonnenen Projekt werden wir daher optical imaging Verfahren einsetzen, um die Ausbreitung von Erregung im isthmischen System im Hirnschnitt zu untersuchen. Diese Experimente werden zusammen mit Prof. Schemann (Humanbiologie, TUM) durchgeführt werden.
Obwohl die Möglichkeiten der Elektrostimulation im Hirnschnitt viele Experimente zulassen, ist bei der Untersuchung spezifischer Zellen eine direkte (nicht-synaptische) Stimulation nicht auszuschließen. Um dieses Problem zu umgehen, bauen wir zur Zeit eine uncaging-Apparatur auf. Dabei wird Transmitter, der durch einen chemischen Käfig („cage“) inaktiviert vorliegt, durch einen lokalen Lichtimpuls freigesetzt und kann damit an beliebiger Position des Neurons synaptischen Eingang simulieren.